El objetivo de este trabajo fue estudiar la asociación entre la presencia de distintas citocinas y anticuerpos en la leche materna con el desarrollo de signos y síntomas de dermatitis atópica en lactantes. Se realizó estudio descriptivo, transversal, de casos y controles, evaluación clínica dermatológica (Hannifin y Rajka/SCORAD) en los lactantes, así como la determinación de citocinas y anticuerpos en muestras de leche materna (IgA, IgE, sCD23, IL-10, sCD14, IL-13, TGF-β (ELISA). La severidad de la dermatitis atópica (SCORAD) fue mayor en lactantes de menor edad. Encontramos una fuerte asociación negativa entre los niveles de IgA secretora, los niveles de IL-10 y TGF-β en las muestras de leche materna con la severidad de la dermatitis atópica. En cambio, se observó una asociación positiva entre la presencia de IgE, IL-13 y sCD23 en la leche materna con el desarrollo de DA en lactantes. Así el perfil “pro-atópico” de madres durante la lactancia caracterizado por elevados niveles de IgE total, IL-13 y sCD23 en la leche materna podría favorecer el desarrollo de dermatitis atópica en los lactantes. Al contrario, la presencia de elevados niveles de IgA secretora y citocinas reguladoras como la IL-10 y TGF-β protegen frente al desarrollo de esta patología.
Palabras clave: Dermatitis atópica; Lactantes; Leche materna; IgA; IgE; Citocinas.
The association of different breast milk cytokines and the development of clinical signs and symptoms of atopic dermatitis in infants was studied. A crosssectional study of cases and controls was carried out. A clinical dermatological evaluation was performed (Hannifin y Rajka/SCORAD) in the infants, as well as the determination of cytokines and antibodies in breast milk (I gA, IgE, sCD23, IL-10, sCD14, IL-13, TGF-β (ELISA). The severity of atopic dermatitis (SCORAD) was higher in younger infants. A strong negative association between levels of secretory IgA, levels of IL-10 and TGF-β in breast milk with the severity of atopic dermatitis was found. In contrast it was observed a positive association between the presence of IgE, IL-13 and sCD23 in breast milk samples with the development of DA in infants. Thereby a “proatopic” profile of lactating mothers characterized by high levels of total IgE, IL- 13 and sCD23 in breast milk could favor the development of atopic dermatitis in infants. On the contrary, the presence of high levels of secretory IgA and regulatory cytokines such as IL- 10 and TGF- β protect against the development of this pathology.
Key words: Atopic dermatitis; Infants; Breast milk cytokines; IgA; IgE.
La dermatitis atópica (DA) es un proceso inflamatorio de la piel que comienza habitualmente en la infancia. Se caracteriza por prurito intenso, lesiones con morfología y distribución característica, curso crónico y recidivante. Se inicia en un 85% en los primeros 5 años de vida. La mayoría de los casos se resuelven antes de los 2 años de edad o mejoran en la pubertad (Page et al., 2016). Actualmente hay cerca de 10 millones de personas afectadas, encontrándose en más del 10% de los niños con edad promedio de 7 años (Pols et al., 2016). En Venezuela se han descrito prevalencias muy elevadas de DA en niños de poblaciones urbanas (Rivera et al., 2015) y rurales (Hagel et al., 2014).
El desarrollo y severidad de la DA depende de la interrelación entre factores ambientales e intrínsecos al individuo tales como la susceptibilidad genética, defectos en la barrera cutánea y alteraciones de la respuesta inmune (Pols et al., 2016). Las enfermedades atópicas incluyendo la DA, presentan una respuesta inmune tipo Th2 incluyendo la producción preferencial de citocinas pro inflamatorias como IL-13, IL-4, elevados niveles de Eosinofilia (Brandt, 2011), aumento en los niveles del receptor soluble para la IgE tipo2 (sCD23) (Pène et al., 1988) y elevada producción de IgE frente a alérgenos involucrados en los procesos de sensibilización alérgica (Brandt, 2011; Heeringa et al., 2018). Las citocinas con perfil Th2 pueden tener un fuerte impacto en la respuesta inmune de la piel y la función de la barrera cutánea. Existen evidencias de que tanto IL-4 como IL-13 disminuyen significativamente la expresión de genes para proteínas estructurales clave como filagrinas, queratina, hornerina, desmogleína y desmocolina entre otras. También alteran la composición lipídica contribuyendo así al aumento de la pérdida de agua transepidérmica (Bieber, 2020). Además, tanto la IL-4 como la IL-13 disminuyen la producción de péptidos antimicrobianos en los queratinocitos (Clausen et al., 2016) y por lo tanto juegan un papel en la disbiosis de la piel caracterizada típicamente por una fuerte colonización con Staphylococcus aureus, empeorando las lesiones de DA (Nakatsuji et al., 2017). Además, se ha reportado en modelos experimentales in vitro que la IL-13 regula negativamente la expresión de MMP-13 en fibroblastos dérmicos humanos disminuyendo así la degradación del colágeno, lo que resulta en fibrosis con un depósito excesivo de colágeno (Bieber, 2020), característica de la liquenificación, un signo clínico de DA. Otro factor importante en la etiología de la DA es la concurrencia de alergia alimentaria (Cartledge y Chan, 2018; Graham y Eigenmann, 2020; Tsakok et al., 2016), la cual a su vez se asocia fuertemente a la pérdida de la tolerancia frente a macromoléculas derivadas de los alimentos (De Martinis et al., 2020; Fehervari, 2019). En condiciones normales, las células T reguladoras en la mucosa intestinal producen constantemente TGF-β el cual estimula selectivamente la producción de anticuerpos IgA (Satitsuksanoa et al., 2018). La IgA contribuye a la eliminación de macromoléculas proalergénicas por medio de mecanismos de exclusión (Cerutti y Rescigno, 2008) evitando así la sensibilización frente a alérgenos alimentarios y el consecuente desarrollo de DA. Además, citocinas como TGF-β e IL-10 pueden inhibir procesos inflamatorios mediados por IL-13 e IL-4 reduciendo las manifestaciones cutáneas de atopia (Satitsuksanoa et al., 2018).
Está ampliamente demostrado que la lactancia materna protege de las enfermedades infecciosas y reduce en más de la mitad de la tasa de mortalidad infantil. La Organización Mundial de la Salud recomienda la lactancia materna exclusiva durante 6 meses antes de introducir alimentos sólidos (Dawod y Marshall, 2019). En los últimos 20 años, se han identificado múltiples citocinas y factores inmunomoduladores (lípidos, carbohidratos entre otros) en la leche materna (Berdi et al., 2019; Dawod y Marshall, 2019). Muchos de estos factores se derivan de las células epiteliales de la glándula mamaria o de las células del sistema inmunitario que se encuentran en la leche, mientras que otros se transfieren de la circulación de la madre (Brandtzaeg, 2010). Estos componentes de la leche materna podrían afectar el desarrollo de la tolerancia oral neonatal a través de mecanismos de modulación inmunológica y ejerciendo influencia sobre la función de barrera epitelial (Barrera y Sánchez, 2016; Figueroa-Lozano y de Vos, 2019) y el microbioma intestinal (Cacho y Lawrence, 2017; Sitarik et al., 2017). Existen evidencias de que TGF-β, IL-10, IL-6 y sCD14 en la leche materna tienen un impacto positivo en el desarrollo de tolerancia frente a antígenos alimentarios (Brandtzaeg, 2010; Dawod y Marshall, 2019). Además, se ha reportado que los niveles de IgA en la leche materna correlacionan positivamente con las concentraciones de TGF-β, IL-10 e IL-6 en la leche materna (Böttcher et al., 1999; Dawod y Marshall, 2019). A su vez, altos niveles de IgA en la leche materna protegen contra el desarrollo de enfermedades alérgicas, incluida la alergia a la proteína de la leche de vaca (Rajani et al., 2018; Seppo et al., 2017). Sin embargo, la condición de atopia en la madre puede influir en el perfil inmunológico de la leche materna. Así, trabajos realizados en muestras de leche materna y calostro han demostrado que los valores de TGF-β1 son menores en las muestras de madres atópicas que aquellos medidos en muestras de madres no atópicas (Böttcher et al., 1999; Rigotti et al., 2006). También se han reportado elevados niveles de lactoferrina e IL-17 en muestras de leche materna de madres atópicas comparados con los observados en muestras de madres no atópicas. Más aún se ha reportado una asociación positiva entre los niveles de lactoferrina e IL-17 con el desarrollo de manifestaciones de alergia en los niños de madres atópicas (Polonkai et al., 2016).
Tomando en cuenta estos hallazgos y la elevada prevalencia de DA en la población infantil venezolana, se realizó un estudio preliminar de las posibles asociaciones entre el perfil de citocinas y anticuerpos presentes en la leche materna y el desarrollo de DA en un grupo de lactantes venezolanos.
Población estudaida: Se realizó un estudio descriptivo, transversal, de casos y controles en lactantes (3-12 meses) evaluados en la Consulta de Dermatología pediátrica del Instituto de Biomedicina que acudieron por trastornos dermatológicos. Los casos fueron lactantes con dermatitis atópica y los controles sin dermatitis atópica ni infecciones de piel o que comprometían las mucosas. Todos los niños participantes recibían para el momento de la evaluación lactancia materna. El trabajo fue aprobado por la Comisión de Ética del Instituto de Biomedicina. Los padres o representantes firmaron el consentimiento informado. Fueron excluidos del trabajo lactantes que no recibían lactancia materna (sólo fórmulas de leche artificial) y aquellos cuyas madres padecían algún tipo de enfermedad de etiología inmunológica (vitíligo, dermatitis por contacto, artritis reumatoide, lupus eritematoso, entre otras) o inmunocomprometidas (VIH positivas).
Evaluación clínica: Previo llenado y firmado de la hoja de consentimiento informado por cada representante legal del paciente, se procedió a realizar examen físico de la piel, siguiendo los criterios para diagnóstico de DA establecidos por Hannifin y Rajka (Hannifin y Rajka, 1980) y valoración de la severidad según el SCORAD (Oranje et al., 2007). Se verificaron los antecedentes clínicos del niño y de la madre.
Relación de las muestras de leche materna: Las madres de los lactantes exprimieron directamente en un tubo conteniendo inhibidores de proteasas, 3 mL de leche materna. Las muestras luego fueron centrifugadas y el sobrenadante se guardó a -10oC en tubos Eppendorf conteniendo 1μL de un coctel de inhibidores de proteasas (Sigma Aldrich).
Niveles de anticuerpos y citocinas en leche materna: La medición de anticuerpos en leche materna se realizó mediante la técnica de ELISA reportada previamente para la medición de anticuerpos en saliva (Ortiz et al., 2000; Rodríguez et al., 2011, 2004). Se utilizó una concentración de 1μg/100μL para el anticuerpo de captura de IgE (I6510 Sigma Aldrich) y de 2μg/100μL para el de IgA (I6635 Sigma Aldrich). El anticuerpo conjugado con peroxidasa se utilizó a una dilución de 1:2000 para IgE (A9667 Sigma Aldrich) y 1:3000 para IgA (AO295 Sigma Aldrich). Las muestras de leche materna se diluyeron 1:2 en ambos casos. En cada ensayo se incluyó una curva de calibración utilizando IgA humana de calostro como estándar (I-1010, Sigma Aldrich) o IgE monoclonal humana (native human IgE protein ab65866, ABCAM). Los resultados fueron expresados en ug/mL. Los valores de sCD14, sCD23, IL-13, IL-10 y TGF-β1 en muestras de leche materna se evaluaron mediante ensayos comerciales (Quantikine, R&D systems) y fueron expresados en pg/mL.
Análisis estadísticos: Se realizó utilizando el programa GraphPad InStat versión 3.00 para Windows (GraphPad Software, San Diego California USA). Se realizó un análisis de varianza (ANOVA) no paramétrico. Se compararon las medianas de los valores de los distintos parámetros empleando la prueba de Kruskal-Wallis. Para establecer las correlaciones entre las variables se utilizó el coeficiente de correlación de Spearman.
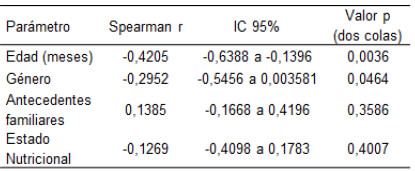
Participaron en este estudio un total de 46 lactantes y sus madres, 18 niños sanos (controles) y 28 niños con DA, que acudieron a la Consulta de Dermatología Pediátrica del Instituto de Biomedicina durante un año. La mediana de edad de los pacientes estudiados fue de 11 meses. Se encontró una asociación significativa inversa (p=0,0036) entre el SCORAD de los pacientes y la edad. El género, los antecedentes familiares y el estado nutricional, no tuvieron influencia en el SCORAD (Tabla 1).
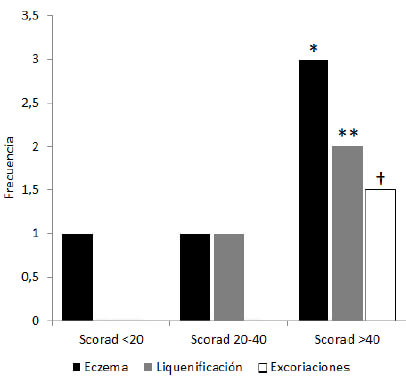
Se compararon estadísticamente las medianas de los valores de distintos signos clínicos mediante ANOVA no paramétrico (prueba de Kruskal-Wallis) encontrándose una diferencia significativa (p<0,005) entre las medianas de los valores de eczema, liquenificación y excoriaciones correspondientes a los grupos de niños con SCORAD<20 y aquellos con SCORAD entre 20-40 o >40 (Figura 1).
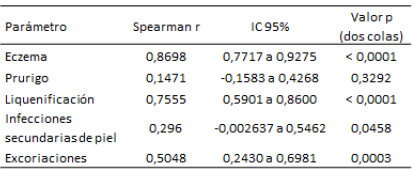
La tabla 2 muestra la contribución de cada signo clínico al SCORAD (Correlación de Spearman) en donde se evidencia que el eczema, la liquenificación, y las excoriaciones contribuyeron significativamente al SCORAD (p<0,0001). Se encontró una asociación leve con las infecciones secundarias (p=0,048). Ningún paciente presentó prurigo.
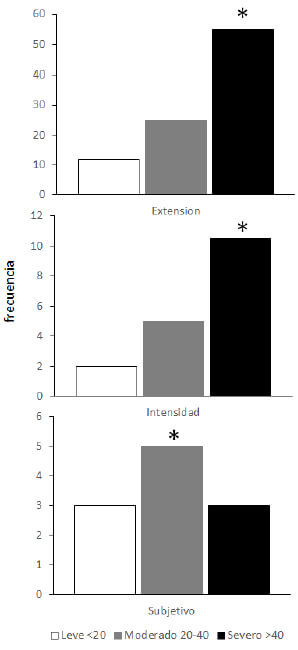
En la figura 2 se observa un aumento progresivo acorde con el SCORAD de los componentes Extensión, Intensidad y Subjetivo, siendo las medianas de estos valores significativamente más elevadas (p<0,0001) en el grupo con DA severa (Scorad >40) para los componentes Extensión e Intensidad mientras que el componente Subjetivo fue significativamente mayor (p<0,005) en los moderados (SCORAD 20-40).
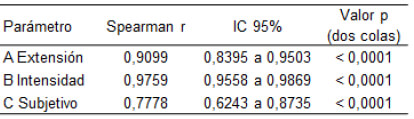
La tabla 3 muestra que los tres componentes (Extensión, Intensidad y Subjetivo) contribuyen similarmente (p<0,0001) al SCORAD.
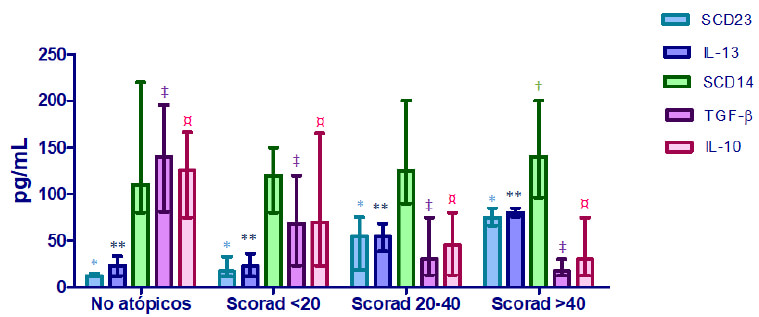
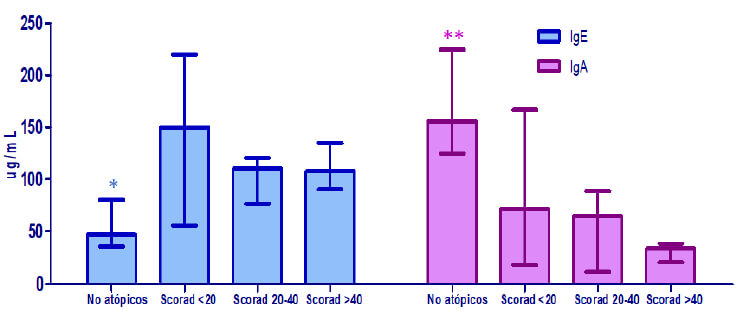
En la figura 3 se muestra las medianas de los valores de distintas citocinas medidas en leche materna de acuerdo a la presencia y severidad de la DA (SCORAD). Se puede observar que los valores de sCD23 e IL-13 aumentaron progresivamente en forma significativa (p<0,005) acorde a la severidad de la DA. En cambio, los niveles de IL-10 y TGF-β1 disminuyen progresivamente con la severidad de la DA siendo más bajos en los niños con DA severa (p<0,0001). Además, se evidencia como los niveles de sCD14 en leche materna fueron comparables en los distintos grupos encontrándose un leve aumento de los valores de esta citocina en los niños con DA severa (p<0,05). Los valores de IgE total fueron significativamente más elevados (p<0,0001) en la leche materna de las madres cuyos lactantes presentaron DA comparados con el grupo control (Figura 4). Sin embargo, las medianas de los valores de IgE en leche materna correspondientes a los grupos con DA moderada (SCORAD: 20-40) y severa (SCORAD>40) fueron significativamente más bajas (p<0,005), que aquellas encontradas en el grupo con DA leve. Al contrario, los niveles de sIgA en leche materna fueron extremadamente más elevados (p<0,0001) en la leche materna correspondiente a los niños no atópicos (Figura 4). Los mismos disminuyeron progresivamente acorde a la severidad de la DA.
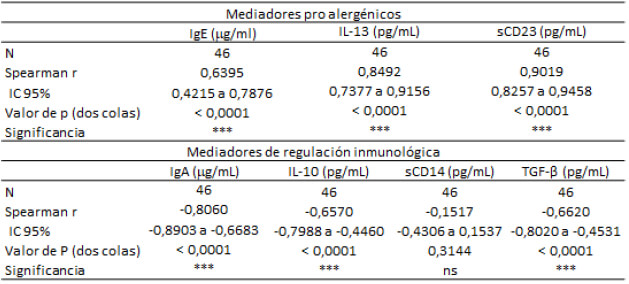
Se encontró además una correlación positiva extremadamente significativa entre los valores de sCD23, IL-13 e IgE total con la severidad de la DA (SCORAD) (Tabla 4). En cambio, las citocinas reguladoras como TGFβ-1 e IL-10 a csíomo los valores de IgA total se asociaron negativamente (p<0,001) a la severidad de la DA (Tabla 4).
La dermatitis atópica (DA) se caracteriza por la localización típica de lesiones específicas de la piel de acuerdo a la edad. Los pacientes estudiados fueron lactantes, menores de 2 años, con una mediana de edad de 11 meses, lo cual determinó los hallazgos característicos del SCORAD para ese grupo etario (Pucci et al., 2005). Se encontró que la edad influyó en el SCORAD de los pacientes, ya que a menor edad, la severidad del SCORAD era mayor. El hecho de que la severidad de la DA sea mayor en lactantes más pequeños sugiere un mayor riesgo a contraer infecciones de la piel en este grupo etario. Estudios previos han aportado evidencias de que la infección por S. aureus precede en algunos casos el diagnóstico clínico de DA (Meylan et al., 2017). Por eso es importante estudiar los factores que pueden proteger o no frente a la DA en lactantes, particularmente en aquellos grupos de niños en alto riesgo social y biológico en donde las infecciones de la piel pueden conducir a situaciones de salud más complicadas. Se evidenció que el eczema, la liquenificación y las excoriaciones contribuyeron significativamente en forma similar al SCORAD, siendo las características clínicas más frecuentes en este grupo etario. Estos resultados coinciden con hallazgos de un estudio previo para evaluar la sensibilidad del SCORAD en niños y en lactantes, en el cual se encontró que cada parámetro del SCORAD contribuye de forma similar a la severidad de la DA en lactantes (Pucci et al., 2005). Así estos resultados confirman que el SCORAD es un sistema adecuado para medir cuantitativamente la severidad de la DA en este grupo etario.
Ha sido ampliamente aceptado el hecho de que la lactancia materna tiene un papel importante en la prevención de patologías alérgicas (De Martinis et al., 2020; Rajani et al., 2018). Las glándulas mamarias son parte del sistema inmune de las mucosas y que los anticuerpos y citocinas presentes en la leche materna son por lo tanto un reflejo de la estimulación del sistema inmune asociado a la mucosa tanto respiratoria como intestinal en la madre (Brandtzaeg, 2010). Por esto, el micro ambiente inmunológico de la madre influye profundamente en el perfil de mediadores inmunológicos que recibe el niño durante la lactancia, así como en el perfil inmunitario que desarrolla. De hecho se ha considerado la lactancia materna como un ingenioso sistema de integración natural entre el sistema inmune de la madre y el del niño (Brandtzaeg, 2010). En este trabajo, la presencia y severidad de la DA en el grupo de lactantes evaluados, se asoció al perfil inmunitario de la leche materna. Elevados niveles de citocinas y anticuerpos proalérgénicos presentes en la leche materna contribuyeron al desarrollo y a la severidad de las lesiones de DA en el grupo de niños evaluado. La relación estrecha entre el consumo por parte de la madre atópica de alimentos potencialmente alergénicos durante el embarazo y la lactancia, además de la producción de citocinas como IL-4 e IL-13 (Lee et al., 2016; Metcalfe et al., 2016), podría favorecer la sensibilización alérgica frente a antígenos alimentarios en el lactante. De hecho, como se mencionó en la introducción, se han reportado valores más elevados de IL-13 e IL-4 en muestras de leche materna de madres atópicas comparados con los de madres no atópicas (Böttcher et al., 1999). También, niveles elevados de IL-13 en muestras de leche materna de madres suecas han sido asociados con manifestaciones de atopia en sus respectivos lactantes (Tomičić et al., 2010). Sin embargo un estudio más reciente realizado en muestras de leche materna proveniente de distintos países europeos reportó que la presencia de IL-13 en dichas muestras tiene un papel protector frente al desarrollo de alergia durante el primer año de vida (Munblit et al., 2017). Se necesitaría un estudio más preciso sobre el efecto que esta citocina puede tener en el desarrollo inmune del lactante y sobre que parámetros podría estar actuando. También trabajos preliminares han demostrado que los niveles de IgE en la madre de niños que recibieron lactancia materna se relacionan positivamente con el desarrollo de manifestaciones alérgicas en los niños durante la primera infancia (Wright et al., 1999). En este trabajo, los niveles de IgE total en la leche materna de los niños con DA severa y moderada fueron más bajos que aquellos encontrados en la leche materna correspondiente a los niños con DA leve. En trabajos anteriores se ha reportado que niveles muy elevados de IgE total pueden bloquear el mecanismo de sensibilización de los mastocitos y la producción de IgE específica frente a distintos alérgenos particularmente en poblaciones tropicales expuestas a parásitos helmintos (Hagel et al., 2013). Es conocido el hecho de que estas parasitosis estimulan de forma no específica elevados niveles de IgE total (Hagel et al., 2013). En distintos modelos experimentales se ha reportado que el sCD23 actúa como una citocina inductora de la proliferación de linfocitos B productores de IgE (Pène et al., 1988; Saxon et al., 1990; Scheffel et al., 2005). Trabajos anteriores realizados en distintos grupos de niños en Venezuela han reportado elevados niveles de sCD23 en suero (Hagel et al., 2006) y saliva (Rivera et al., 2015) de niños atópicos con manifestaciones cutáneas de alergia: En este trabajo encontramos que los niveles de sCD23 fueron muy elevados en las muestras de leche materna correspondientes a los niños con DA, correlacionando positivamente con el SCORAD, no obstante, es la primera vez que se reportan elevados niveles de sCD23 en leche materna en la literatura (hasta donde pudimos investigar), por lo que se necesitarían más estudios para confirmar estos hallazgos y analizar con mayor profundidad los mecanismos inmunológicos que esta citocina pudiera mediar en los niños lactantes.
A diferencia de lo observado en el grupo de niños con DA, en el perfil inmunológico de la leche materna correspondiente a niños sanos, hubo un claro predominio de factores reguladores de la respuesta inmune con respecto a los mediadores pro alergénicos. Más aún se encontró una correlación inversa entre la presencia de IgA secretora, TGF-β1 e IL-10 en la leche materna con la severidad de la DA. Existen evidencias de que valores elevados de TGF-β1 e IL-10 en la leche materna protegen frente al desarrollo de alergia (Berdi et al., 2019; Dawod y Marshall, 2019) y consecuentemente frente a la DA. También se ha demostrado en otros estudios el valor protector de la sIgA en la leche materna en relación con la presencia y severidad de la DA (Orivuori et al., 2014).
En este trabajo no se encontró ninguna relación importante entre los niveles de sCD14 soluble medidos en leche materna con la presencia y la severidad de la DA, evidencias en trabajos realizados en otros países han sugerido que niveles reducidos de sCD14 en la leche materna se asocian con el desarrollo de atopia, excema o ambos (Hua et al., 2019) mientras que otros trabajos no han encontrado ninguna asociación (Logan et al., 2018), en este sentido, valdría la pena en estudios posteriores evaluar las diferencias de los valores de sCD14 en muestras de leche materna de madres sometidas a distintos retos antigénicos y su impacto en el perfil inmunológico de los niños. Otro aspecto importante que influye en el control del desarrollo temprano de enfermedades atópicas es el tipo de bacterias que colonizan y forman tempranamente el microbioma en la mucosa intestinal (Kim et al., 2019). Este proceso es influenciado por pre bióticos presentes en la leche materna que también pueden jugar un papel importante en la prevención del desarrollo de atopia durante la primera infancia (Brosseau et al., 2019). De hecho los oligosacáridos de la leche materna humana, promueven la maduración de la microbiota, estimulando tempranamente el crecimiento de bifidobacterias las cuales están involucradas en el desarrollo de tolerancia frente a los alimentos y así en la prevención de alergias y el desarrollo de DA (Akkerman et al., 2019). En conclusión, nuestros resultados indican que la presencia de un perfil “proatópico” caracterizado por elevados niveles de IgE total, IL-13 y sCD23 en la leche materna favorece el desarrollo de dermatitis atópica en los lactantes.
Mientras que, la presencia de elevados niveles de IgA secretora y citocinas reguladoras como la IL-10 y TGF-β1 en la leche materna, protegen frente al desarrollo de esta patología. Por esto, es necesario realizar estudios con evaluaciones más minuciosas sobre los diferentes procesos inflamatorios de las madres, como infecciones exposición frente a alérgenos o procesos autoinmunes, para evaluar los efectos ocasionados por estos factores durante el periodo de la lactancia. Esto permitirá modificar el perfil inmunológico de la leche materna ayudando al desarrollo armónico del sistema inmune en el lactante y prevenir la aparición de signos clínicos de DA.