La osteólisis peri-implante es un problema post-cirugías traumatológicas causando un proceso inflamatorio crónico que conduce a la perdida de la prótesis. En este proceso inflamatorio crónico se han identificado varios mediadores como lo son el TNF-α y la IL-6. Además, el TNF-α y la IL-6 estimulan el reclutamiento y activación de los macrófagos responsables de la resorción ósea, conduciendo al aflojamiento de la prótesis. El efecto del TNF-α y la IL-6 fueron evaluados sobre cultivos de osteoblastos aislados de calvarías de ratas neonatales Sprague-Dawley. La viabilidad celular se evaluó con la tinción de azul de tripano, así como la proliferación celular mediante el método MTS-PMS. Para la identificación específica de los osteoblastos se utilizó la fosfatasa alcalina. Adicionalmente se procedió a la evaluación cualitativa del proceso de osificación, mediante técnica de tinción con rojo de alizarina y la evaluación cuantitativa del proceso de osificación, utilizando la técnica de la determinación de hidroxiapatita. El TNF-α y la IL-6 fueron capaces de producir una inhibición en la actividad de la fosfatasa alcalina y de la proliferación celular, produciendo una disminución en el proceso de osificación y mineralización de los osteoblastos. En la presencia del TNF-α se observó un efecto bifásico novedoso, a bajas concentraciones produce una estimulación de la fosfatasa alcalina y la proliferación celular mientras que a altas concentraciones más de 10 ng/ml se observó una inhibición. Estos resultados permiten entender el papel del TNF-α y la IL-6 en los mecanismos fisiopatológicos asociados a la osteólisis peri-implante. Este trabajo fue financiado por CDCH-UCV # PI-09-7726.2009/2 (ILB).
Palabras clave: TNF-α, IL-6, Osteoblastos, Osteolisis.
Peri-implant osteolysis is a problem post-surgery trauma causing a chronic inflammatory process that leads to the loss of the prosthesis. In this chronic inflammatory process, several mediators have been identified, such as TNF-α and IL-6. In addition, TNF-α and IL-6 stimulate the recruitment and activation of macrophages responsible for bone resorption, leading to loosening of the prosthesis. The effect of TNF-α and IL-6 were evaluated on osteoblasts isolated cultures of calvarías from neonatal Sprague-Dawley rats. Cell viability was evaluated with the trypan blue staining, as well as cell proliferation through the MTS-PMS method. For the specific identification of osteoblast, alkaline phosphatase was used. In addition was the qualitative evaluation of the process of ossification, using technique of staining with red Alizarin and the quantitative evaluation of the process of ossification, using the technique of determination of hydroxyapatite. TNF-α and IL-6 were able to produce an inhibition on the activity of alkaline phosphatase and cell proliferation, producing a decrease in the process of ossification and mineralization of osteoblasts. A novel biphasic effect was observed in the presence of TNF-α, at low concentrations produces a stimulation of alkaline phosphatase and cell proliferation while at high concentrations over 10 ng/ml was observed an inhibition. These results allow us to understand the role of TNF-α and IL-6 in associated with osteolysis peri-physiopathological mechanisms implant. This work was funded by CDCH-UCV # PI-09-7726.2009/2 (ILB).
Key words: TNF-α, IL-6, Osteoblasts, Osteolysis.
El conjunto estructural integrado por huesos y cartílagos, el cual es denominado sistema esquelético, puede sufrir ciertas patologías agudas: accidentes, traumatismos y crónicas más frecuentes como son la osteoporosis y una diversidad de osteoartritis, tumores e infecciones crónicas generando artritis séptica hasta llegar a una osteomielitis. Es relevante para este trabajo la existencia de otras enfermedades crónicas de origen iatrogénico como son la osteólisis peri-implante, el aflojamiento aséptico y séptico de los dispositivos o prótesis que se caracterizan por daños en la matriz ósea y a alteraciones en las células que la componen, en especial a los osteoblastos (Malech et al. 1987).
Las patologías antes mencionadas están asociadas a procesos inflamatorios crónicos donde participan varios tipos de células siendo las más relevantes, el macrófago y el linfocito T (Kumar et al. 2009).
Los macrófagos y linfocitos interactúan entre sí de una manera que ayuda a estimular a diferentes tipos de células. Estas células activadas liberan mediadores inflamatorios tales como interferón gamma (IFNγ), interleuquina 1 (IL-1) y factor de necrosis tumoral (TNF-α). El IFN-y ayuda a activar los macrófagos así como en los procesos inmunes innatos. La IL-1 tiene un efecto pro inflamatorio. El TNF-α participa en la regulación de las células inmunológicas (Kumar et al. 2009).
Estas células producen una gran variedad de citoquinas que pueden afectar la fisiología del osteoblasto e interferir en la producción de matriz ósea, hay que enfatizar que es la única célula capaz de producir material óseo nuevo. Entre estas citoquinas capaces de alterar la diferenciación y la proliferación de los osteoblastos se han evaluado el factor de necrosis tumoral (TNF-α) y la interleuquina 1 (IL-1) y la interleuquina 6 (IL-6) (Kwan et al. 2004). Este proceso inflamatorio produce la inhibición de la actividad de osteogénesis, así como la disminución en la mineralización ósea. Por lo anterior en este trabajo se estudia el comportamiento de osteoblastos en cultivo aislados de calvarías de ratas neonatales Sprague-Dawley en la presencia de estas 2 citoquinas como son la IL-6 y el TNF-α.
Los osteoblastos se aislarán a partir de calvaría de ratas neonatas siguiendo la metodología descrita por (Isabel et al. 2012). Brevemente, los osteoblastos serán aisladas a partir de la calvaría de 8 ratas Sprague-Dawley del Bioterio del Instituto de Medicina Experimental (IME) de 2-3 días de nacidas. Las calvarías serán diseccionadas bajo condiciones asépticas y limpiadas de los tejidos blandos circundantes todo el proceso se realizara a temperatura ambiente. Luego se realizarán 3 lavados consecutivos con PBS 1X, se eliminará el periostio. Las calvarías serán cortadas en trozos de 1 mm2 aproximadamente y se incubarán las calvarías en solución de digestión, la cual contendrá: DMEM tripsina 1%, (1ml por hueso de calvaría) durante 10 min. Posteriormente se centrifugarán 1500 x g x 5 min. El sobrenadante resultante de la primera extracción será descartado y se le agregará DMEMs para detener la acción de la tripsina y luego se incubarán en una solución de colagenasa 0,2% (aproximadamente 800µl por hueso de calvaría) por 30 min. Posteriormente se centrifugará 1500 x g x 5 min y la solución conteniendo de colagenasa se descartará y se agregará una nueva solución de colagenasa pero ahora el tiempo de incubación será de 60 min, seguido por una centrifugación a 1500 x g x 5 min. El sedimento celular será re-suspendido en 5 ml de DMEMs. y se centrifugará a 1500 x g x 5 min por última vez y el botón celular será resuspendido en DMEMs (1ml ) por calvaría.
La suspensión celular (1ml) se le agregará 20 ml de DMEMs y serán sembrados en un recipiente T-75 cm2. Las células serán mantenidas a 37 °C en atmósfera húmeda y 5% CO2. El medio será cambiado a las 24 horas de cultivo, posteriormente se realizarán cambios interdiarios hasta completar una confluencia de 90% aproximadamente. Una vez confluente, el cultivo celular se realizó pasajes logrando una homogeneidad celular a partir del tercer pasaje.
La proliferación celular fue determinada utilizando el método de MTS-PMS (Riss et al.1992). El contaje celular empleando Hemocitómetro y determinación de la viabilidad celular se realizó utilizando Azul de tripano al 0,4% (Phillips et al.1957, Ricardo R, et al. 2008).
La determinación enzimática para la fosfatasa alcalina en osteoblastos de rata. (Granjeiro et al. 1997, De Souza Malaspina et al. 2008) y el ensayo bioquímico se fundamenta en la hidrólisis del p-nitrofenilfosfato, un substrato sintético, que es hidrolizado por la enzima fosfatasa en medio alcalino (pH 9,4), lo cual se define como actividad de fosfatasa alcalina (FA). El medio de incubación contendrá 100 mM Glicina-NaOH, 2mM MgCl2, 5mM p-NPP. Las células adheridas a las placas de 96 pozos, el medio de incubación será removido y se lavarán con PBS. En cada pozo se añadirá 10 µL de la solución de extracción. Dejar por 5 min a temperatura ambiente y se diluirá con 40 µL de agua hasta 50 µL y se agitará suavemente. Luego se añadirá 125 µL 100 mM Glicina-NaOH, 2mM MgCl2, 5mM p-NPP. La reacción se detendrá añadiendo 125 µL de 1 N NaOH. Posteriormente, se procederá a leer a 405 nm en lector ELISA (Coeff extinción molar: 18.000 M-1cm-1). La actividad enzimática se expresa en actividad específica= nmoles p-NPP/min/mg of proteínas.
La actividad enzimática se expresará en actividad específica como nmoles p-Nitrofenol/min/mg de proteínas. Además, se utiliza el coeficiente de extinción molar: 18.000 M-1cm-1 de lo que se desprende que 1 nmoles p-Nitrofenol absorbe 0.018. Por lo anterior, todas las lecturas de absorbancia a 405 nm/0.018 para obtener los nmoles producidos.
La determinación de las proteínas celulares de osteoblastos según el método (Lowry et al. 1951) modificado por Bensadoun et al. 1976 utilizando albumina sérica de bovino como estándar.
La determinación cualitativa de la osificación mediante la formación de nódulos de mineralización utilizando el rojo de Alizarina (Cao JJ et al. 2005, Gregory et al. 2004).
La tinción de Hematoxilina-Eosina (Kiernan 2008). Esta tinción clásica se realizó con la finalidad de estudiar la estructura celular, forma y localización del núcleo celular. El método supone la aplicación de la tinción de hematoxilina, que por ser catiónica o básica, tiñe estructuras ácidas (basófilas) en tonos azul y púrpura, como por ejemplo los núcleos celulares; y el uso de eosina que tiñe componentes básicos (acidófilas) en tonos de color rosa, en función de su naturaleza aniónica o ácida, como el citoplasma.
La primera aproximación para estudiar el cultivo de los osteoblastos en cultivo fue evaluar la progresión en función del tiempo (24, 48 y 72 hr) de su crecimiento bajo el microscopio de luz, coloración con hematoxilina y eosina y una tinción para la detección de calcio como es el rojo de alizarina, procedimientos que fueron descritos en la metodología descrita.
En la Figura 1 se puede observar mediante la tinción de Hematoxilina-Eosina, el crecimiento progresivo y el cambio de la forma de los osteoblastos, siendo a las 24 hr, células alargadas y transformándose en forma rectangular a las 72 hr. En la parte inferior de la grafica se muestra la tinción con el Rojo de Alizarina, y se puede observar que no existe una fijación del colorante a las 24 hr y aparece alguna material a las 48 hr siendo más definitivo la deposición de material del calcio a las 72 hr de incubación.
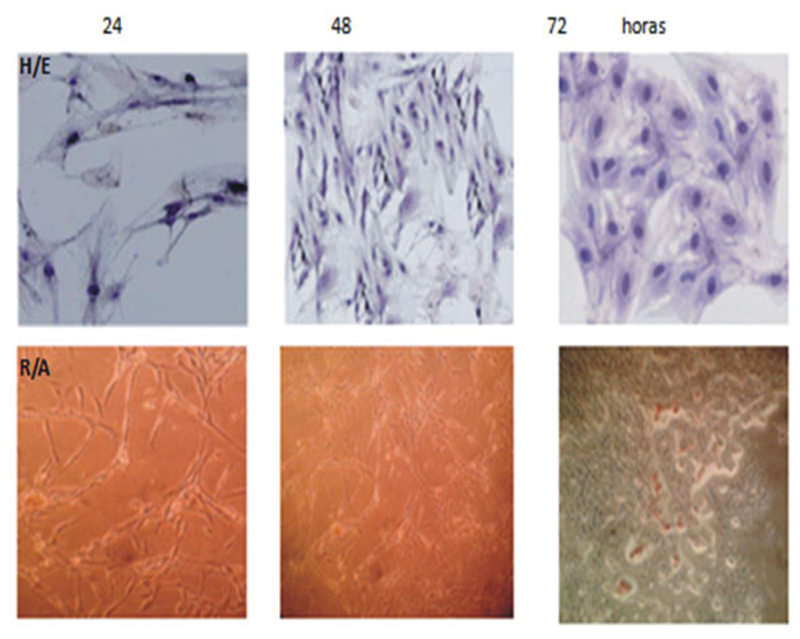
En la Figura 1 se puede observar el comportamiento de los osteoblastos en cultivo a diferentes tiempos, a las 24, 48 y 72 hrs. En la parte superior se observa la coloración de Hematoxilina y Eosina donde a las 24 hrs se observan pocas células de aspectos fusiforme, el número aumenta a las 48 hrs y a las 72 hrs se observa una gran confluencia de los osteoblastos que adoptan una forma casi cuadrada al menos paralelepípedo.
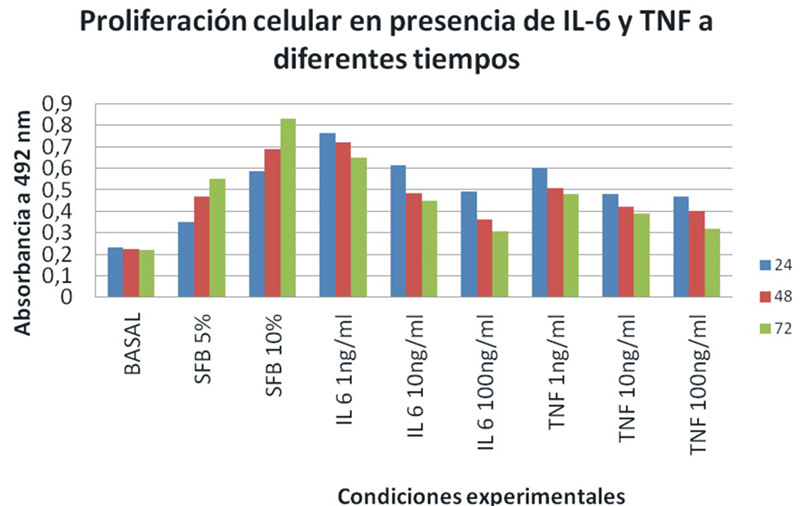
Cuando las osteoblastos en cultivo fueron expuestos a un conjunto de agentes mitogénicos como fueron el suero Fetal Bovino (SFB) a diferentes concentraciones (5,10%) se observó que en función del tiempo de cultivo se aumentaba la proliferación celular con se puede observar en la Figura 2. De manera interesante, bajo las mismas condiciones experimentales, la IL-6 a 1 ng/ml fue capaz de estimular la proliferación de los osteoblastos, pero al aumentar la concentración de esta interleuquina a 10 n/ml se redujo la proliferación celular, siendo mayor a 100 ng/ml. Resultados similares fueron observados en el caso de la otra citoquina como es el TNF α pero la estimulación a 1 ng/ml fue menor para el TNF α en comparación con la IL-6 pero el efecto inhibitorio fue mayor a mayores concentraciones de esta citoquina.
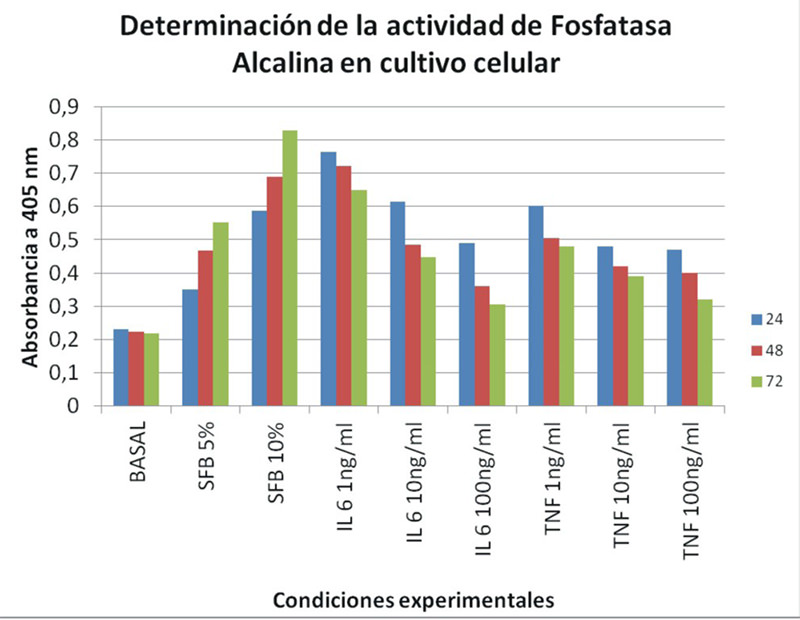
Los resultados anteriores fueron corroborados con la determinación de la actividad de fosfatasa alcalina, la cual es un marcador bioquímico especifico de los osteoblastos, ya que esta enzima está relacionada con la formación de hidroxipapatita, que es el material fundamental para la deposición de material óseo. Estos resultados se muestran en la Figura 3. De nuevo, el SFB a 5 y 10% es capaz de inducir una fuerte expresión de la actividad de fosfatasa alcalína. Cuando las células se expusieron a la IL-6 se observo una estimulación a 1ng/ml, pero la actividad disminuyó al aumentar las concentraciones de la mencionada interleuquina.
El conjunto estructural integrado por huesos y cartílagos, el cual es denominado sistema esquelético, puede sufrir ciertas patologías agudas: accidentes, traumatismos y crónicas más frecuentes como son la osteoporosis y una diversidad de osteoartritis, tumores e infecciones crónicas generando artritis séptica hasta llegar a una osteomielitis. Es relevante para este trabajo la existencia de otras enfermedades crónicas de origen iatrogénico como son la osteólisis peri-implante, el aflojamiento aséptico y séptico de los dispositivos o prótesis que se caracterizan por daños en la matriz ósea y a alteraciones en las células que la componen, en especial a los osteoblastos.
La variación temporal en la respuesta inflamatoria aguda, respuesta inflamatoria crónica, desarrollo de tejido de granulación y reacción de cuerpo extraño con biomateriales implantados. Las variables de intensidad y tiempo dependen de la extensión de la lesión creada en la implantación y el tamaño, forma, topografía y propiedades químicas y físicas del biomaterial (Malech et al. 1987).
Las patologías antes mencionadas están asociadas a procesos inflamatorios crónicos donde participan varios tipos de células siendo las más relevantes, el macrófago y el linfocito T (Kumar et al. 2009).
Los macrófagos y linfocitos interactúan entre sí de una manera que ayuda a estimular a diferentes tipos de células. Estas células activadas liberan mediadores inflamatorios tales como interferón gamma (IFNγ), interleuquina 1 (IL-1) y factor de necrosis tumoral (TNF-α). El IFN-y ayuda a activar los macrófagos así como en los procesos inmunes innatos. La IL-1 tiene un efecto pro inflamatorio. El TNF- α participa en la regulación de las células inmunológicas. (Kumar et al. 2009).
Estas células producen una gran variedad de citoquinas que pueden afectar la fisiología del osteoblasto e interferir en la producción de matriz ósea, hay que enfatizar que es la única célula capaz de producir material óseo nuevo. Entre estas citoquinas capaces de alterar la diferenciación y la proliferación de los osteoblastos se han evaluado el factor de necrosis tumoral (TNF-α) y la interleuquina 1 (IL-1) y la interleuquina 6 (IL-6) (Kwan et al. 2004). Estas citoquinas son capaces de actuar sobre los osteoblastos activando un conjunto de cascadas intracelulares que involucran la familia de las Mitogen-activated protein kinases (MAPK). Nosotros encontramos que a bajas concentraciones de la IL-6 y el TNF-α pueden activar la proliferación celular, posiblemente a través de la vía de la MAPK mientras que a altas concentraciones de la IL-6 y el TNF- α que puede existir en un ambiente de inflamación extenso y crónico se produce una inhibición de la proliferación, por un mecanismo desconocido.
Este proceso inflamatorio produce la inhibición de la actividad de osteogénesis, así como la disminución en la mineralización ósea. Por lo anterior ocurre un desequilibrio entre la osteogénesis y la osteólisis, esta última función realizada por los osteoclastos, células que degradan la matriz ósea. Nuestros resultados sustentan la hipótesis que los osteoblastos, a altas concentraciones de IL-6 y el TNF-α son incapaces de producir matriz ósea, lo cual crea un desequilibrio ya que está severamente afectada la osteogénesis dejando el proceso de osteólisis producida por el osteoclasto sin ningún obstáculo, para degradar la matriz ósea, lo cual afecta de manera significativa al tejido óseo conduciendo a la aparición de patologías que afectan a los pacientes (Malech et al. 1987).
Un resultado novedoso es que en la presencia del TNF-α y la IL-6 se observó un efecto bifásico, a bajas concentraciones produce una estimulación de la actividad de fosfatasa alcalina y la proliferación de los osteoblastos mientras que a altas concentraciones más de 10 ng/ml se observó una inhibición. Estos resultados permiten entender el papel del TNF-α y la IL-6 en los mecanismos fisiopatológicos asociados a los osteoblastos/osteoclastos en la osteólisis peri-implante.
Este trabajo fue financiado por un proyecto de investigación del CDCH-UCV # PG-09-8629.-13 para la Dra. Itala Lippo De Becemberg.